Электровыделение металлов |
Термодинамика процесса электролитической диссоциации
 от температуры, рассматриваемая в широком температурном интервале — от температуры
от температуры, рассматриваемая в широком температурном интервале — от температуры
 однозначно с изменением температуры. Из
однозначно с изменением температуры. Из
 может получить произвольные
может получить произвольные
по абсолютной величине, а нередко и противоположные по знаку величины термодинамических характеристик процесса. Это объясняет имеющиеся в литературе неоднозначные результаты, а в некоторых случаях взаимно исключающие выводы о термодинамике процесса электролитической диссоциации, часть из которых к тому же противоречит физической картине данного процесса.
 то уравнение (1—21) запишется в следующем виде:
то уравнение (1—21) запишется в следующем виде:

 — константы равновесия собственно химических и электростатических взаимодействий в процессе электролитической диссоциации.
— константы равновесия собственно химических и электростатических взаимодействий в процессе электролитической диссоциации.
 —а) по 1/Т, получаем:
—а) по 1/Т, получаем:
Из выражения (1—23), учитывая, что ДО = —RTlnK, и используя известную связь между гибсовой энергией, энтальпией и энтропией процесса, получаем выражение для энтропии процесса электролитической диссоциации:

Из уравнений (1—23, 1—24) видно, что термодинамические характеристики процесса электролитической диссоциации (как, впрочем, и любого иного равновесного процесса в растворе) помимо химической и электростатической составляющих определяются также температурным изменением диэлектрической проницаемости. Для разделения влияния этих факторов авторы предложили расчленить термодинамические характеристики равновесного процесса на температурную и диэлектрическую составляющие:

Температурные составляющие термодинамических характеристик процесса — это величины, которые определяют его течение в среде с неизменной диэлектрической проницаемостью (т.е.


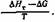 Соответственно диэлектрические составляющие — это составляющие термодинамических характеристик процесса взаимодействия, которые определяются температурным изменением диэлектрической проницаемости:
Соответственно диэлектрические составляющие — это составляющие термодинамических характеристик процесса взаимодействия, которые определяются температурным изменением диэлектрической проницаемости:


 (рис. 7, б).
(рис. 7, б).
 как
как
 для двух температур представлен на рис. 7, о.
для двух температур представлен на рис. 7, о.
Сопоставление величин, приведенных в табл. 3, подтверждает высказанный выше тезис о большей информативности величин

 также не согласуются с физической моделью процесса электролитической диссоциации. Действительно, с понижением величины диэлектрической проницаемости (т. е. при переходе от водно-метаноловых растворителей к пропаноловому) степень структурирования ионов, образовавшихся из электрически нейтральных ионных пар, должна повышаться, следовательно, в том же направлении должна расти экзоэнтропийность процесса.
также не согласуются с физической моделью процесса электролитической диссоциации. Действительно, с понижением величины диэлектрической проницаемости (т. е. при переходе от водно-метаноловых растворителей к пропаноловому) степень структурирования ионов, образовавшихся из электрически нейтральных ионных пар, должна повышаться, следовательно, в том же направлении должна расти экзоэнтропийность процесса.


 —
—
 должно было бы привести к заведомо неверному выводу о том, что переход от водно-метаноловых растворителей к пропаноловому вызывает изменение природы сольватации.
должно было бы привести к заведомо неверному выводу о том, что переход от водно-метаноловых растворителей к пропаноловому вызывает изменение природы сольватации.



