Электровыделение металлов |
Характеристики растворителей, электроосаждения металлов
Классификация растворителей
Очевидно, что одной рациональной системы классификации растворителей быть не может. В зависимости от количества и общности признаков, лежащих в основе данной системы классификации, может существовать громадное число таких систем. Поэтому можно говорить лишь об общих системах классификации растворителей, наиболее пригодных для практики.

 в интервале 12—50, к высокополярным — растворители с е>50.
в интервале 12—50, к высокополярным — растворители с е>50.

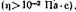


При подборе композиций, исходя из описанной выше (см. параграфы и 1. 3. 4) связи между электропроводностью и вязкостью, следует стремиться к растворителю с минимально возможной вязкостью.
Между термодинамическими параметрами активации вязкого течения и структурными характеристиками жидкости существует достаточно четкая связь. Поэтому эти величины позволяют судить о степени структурирования жидкости.
С очевидной ориентацией на температуру кипения воды растворители подразделяют на низкокипящие (температура кипения ниже 100 °С), среднекипящие (температура кипения 100—150 °С) и высококипящие (температура кипения выше 150 °С).
По летучести растворители предложено классифицировать по относительной шкале, в которой за единицу принята летучесть диэтилового эфира при 20 °С и относительной влажности 65+5 %. В соответствии с этим различают легколетучие (число испарения ниже 10), среднелетучие (число испарения 10—35) и труднолетучие (число испарения выше 35). Для удобства и безопасности работы (в тех случаях, когда растворители токсичны либо огне- или взрывоопасны) при подборе электролитных композиций при прочих равных условиях следует выбирать растворитель, наиболее высококипящий и труднолетучий.
б). Классификация растворителей, основанная на химических свойствах растворителей. Нередко растворители подразделяют в соответствии с рациональной классификацией химических соединений. Очевидная прагматичность такой системы в данном случае должна считаться достаточно целесообразной, так как растворители одного химического типа помимо аналогии в химическом поведении часто весьма подобны и по физическим характеристикам (за исключением первых членов гомологических рядов органических соединений—метанола, формальдегида, муравьиной кислоты и т. п.).
Классификация растворителей, основанная на их кислотно-основных свойствах, разбиралась в параграфе 1.4.2. Большинство протолитических растворителей вступает в реакции сольватации с растворенным веществом посредством Н-связи. В соответствии с этим целесообразно классифицировать такие растворители по их способности образовывать Н-связь. По данной классификации растворители подразделяются на пять групп: 1 — жидкости, способные к образованию трехмерной сетки Н-связи (вода, серная кислота, гликоли); эти жидкости характеризуются высокой диэлектрической проницаемостью и хорошей растворимостью друг в друге; 2 — растворители с двухмерной сеткой Н-связей (фенолы, большинство карбоновых кислот, одноатомные спирты); 3 — жидкости, молекулы которых имеют в своем составе электронодо-норные атомы, способные к образованию Н-связи с протоном растворенного соединения (амины, эфиры, кетоны и др.); 4 — жидкости, молекулы которых содержат электронофильные атомы водорода, способные вступать в Н-связь с электронодонорными атомами молекул растворенного вещества (хлороформ, дихлорэтан и т. п.); 5 — растворители, не способные принимать участие в образовании Н-связи (четыреххлористый углерод, гексан, пергалоидированные углеводороды и т. п.).
Достаточно распространена система классификации, предложенная Паркером. В основу ее положена способность растворителя сольватировать ионы. Согласно Паркеру, растворители подразделяются на три группы: 1 — аполярные апротонные растворители, представляющие собой жидкости со сравнительно низкой диэлектрической проницаемостью (ниже 15), молекулы которых обладают невысоким дипольным моментом (сероуглерод, четыреххлористый углерод, третичные амины и т. д.); 2— диполярные апротонные растворители, характеризующиеся сравнительно высокой диэлектрической проницаемостью, молекулы которых имеют сравнительно высокий дипольный момент; если в состав этих растворителей входит водород, то он не может вступать в Н-связь (НБ, НМ, АН, ПК, ДМФА, ДМСО и т. п.); 3— протонные растворители, содержащие электронодефицитный водород, способный образовывать Н-связь (спирты, карбоновые кислоты, фенолы и т. п.).
Сольватирующая способность растворителей по приведенной классификации повышается от первой к третьей группе.
Иные классификации растворителей, основанные на химических признаках, приведены в работах.
в). Классификация растворителей, основанная на сочетании физических и химических свойств растворителей. Брёнстед предложил систему классификации, которая сочетает диэлектрическую проницаемость растворителей и их протогенность (протофильность). В соответствии с этими признаками Брёнстед разделил растворители на восемь групп, отличительные признаки которых сведены в табл. 15. Примерами растворителей типов классификации по Брёнстеду могут служить: I — вода; II — серная кислота, жидкий фтористый водород; III — гидразин; IV — ПК, НМ, НБ, АН; V — одноатомные спирты, фенолы; VI — жидкие галогеноводороды; VII—Ру; VIII—Г, Б. Классификация Брёнстеда позволяет прогнозировать проявление растворенным веществом кислотно-основной функции, а также оценивать нивелирующее либо дифференцирующее действие растворителя на силу электролитов.

 приведены в табл. 12). Предложены
приведены в табл. 12). Предложены
также иные системы классификации растворителя, основанные на сочетании физических и химических свойств.



