Электровыделение металлов |
Электролитическая диссоциация
Заключительная из последних стадий процессов межмолекулярного взаимодействия в растворах—процесс электролитической диссоциации

протекает постольку, поскольку реализуются перечисленные выше предшествующие стадии; очевидное исключение представляют лишь растворы ионофоров, в случае которых процесс электролитической диссоциации состоит лишь из двух стадий — образования сольватированного ионного ассоциата при растворении и распада последнего на ионы.
Общая теория электролитической диссоциации достаточно обстоятельно разработана Н. А. Измайловым. Некоторые положения этой теории кратко будут изложены в разделе 1.2. Здесь же подчеркнем, что протекание процесса электролитической диссоциации является следствием как специфической, так и универсальной сольватации. При этом специфическая сольватация доставляет системе энергию, необходимую для образования ионов, а достаточно высокая диэлектрическая проницаемость обеспечивает распад ионного ассоциата на ионы. Ослабление энергии электростатического взаимодействия в непрерывной среде с диэлектрической проницаемостью е происходит в соответствии с обычным уравнением ион ионного взаимодействия
 термодинамики процесса электролитической диссоциации будут рассмотрены в параграфе 1.2.3.
термодинамики процесса электролитической диссоциации будут рассмотрены в параграфе 1.2.3.
Общая схема равновесий
в растворах электролитов.
Проблема индифферентности растворителя
Описанные выше процессы межмолекулярного взаимодействия в растворах протекают последовательно и, следовательно, взаимосвязаны. Это позволяет считать их отдельными стадиями общей схемы равновесий в растворах, впервые предложенной Н. А. Из майловым и затем детализированной в работе. Общая схема объединяет равновесия (1—1), (1—7), (1—9) и (1—12):

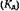 . Из общей
. Из общей
схемы равновесий (1—14) вытекает, что образование электролитного раствора возможно лишь в случае протекания всех стадий, предшествующих процессу электролитической диссоциацией.
Можно выявить общие черты, свойственные каждой из стадий, объединяемых схемой (1—14). Отметим, что свободная энергия, а следовательно, и константа равновесия каждого из процессов определяются энергиями как специфической, так и универсальной сольватацци:
 универсальны-
универсальны-
 как это иллюстрировалось выше на ряде приме-
как это иллюстрировалось выше на ряде приме-
ров (см. рис. 1—3).
 На рис. 3 приведена зависимость
На рис. 3 приведена зависимость
 в условно универсальной среде гораздо меньше, чем в универсальной среде, однако в обоих случаях соблюдается прямолинейность зависимости
в условно универсальной среде гораздо меньше, чем в универсальной среде, однако в обоих случаях соблюдается прямолинейность зависимости
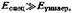 будем называть далее специфическими. Введенная терминология дает основания для рассмотрения вопроса об индифферентных (универсальных) и химически неиндифферентных (специфических) растворителях.
будем называть далее специфическими. Введенная терминология дает основания для рассмотрения вопроса об индифферентных (универсальных) и химически неиндифферентных (специфических) растворителях.
Отнесение данного растворителя к индифферентным либо к химически активным не может быть априорным — без учета химических (а иногда и физических) характеристик растворенного вещества. Энергетика даже электростатической составляющей различных типов межмолекулярного взаимодействия в растворах, определяемая уравнениями (1—4), (1—8), (1—11) и (1—13), разнится в весьма широких пределах.


 примерно на порядок.
примерно на порядок.
![]() = = 175) явление гомомолекулярной ассоциации не наблюдается вообще.
= = 175) явление гомомолекулярной ассоциации не наблюдается вообще.
 (из-за преимущественно донорной природы приведенных в табл. 2 растворителей сольватация пиридина в этой схеме не учитывается).
(из-за преимущественно донорной природы приведенных в табл. 2 растворителей сольватация пиридина в этой схеме не учитывается).

 Естественное объяснение в рамках данной модели находит и закономерное увеличение энтропии процесса по мере основности растворителя.
Естественное объяснение в рамках данной модели находит и закономерное увеличение энтропии процесса по мере основности растворителя.
 свидетельствуя о протекании в этих системах лишь ион-ионных взаимодействий, значения энергии которых, как отмечалось, не менее чем на.порядок превышают величины энергии иных видов электростатических взаимодействий. Такое поведение электролита в данном случае обусловлено большим размером его ионов, резко уменьшающим энергию специфической сольватации молекулами растворителя. Итак, растворитель не может априорно, без учета энергетики рассматриваемого процесса, считаться индифферентным по отношению к протекающему в нем процессу.
свидетельствуя о протекании в этих системах лишь ион-ионных взаимодействий, значения энергии которых, как отмечалось, не менее чем на.порядок превышают величины энергии иных видов электростатических взаимодействий. Такое поведение электролита в данном случае обусловлено большим размером его ионов, резко уменьшающим энергию специфической сольватации молекулами растворителя. Итак, растворитель не может априорно, без учета энергетики рассматриваемого процесса, считаться индифферентным по отношению к протекающему в нем процессу.



