Электровыделение металлов |
Металлы первой группы
 Однако литиевые электроды, как правило, показывают две ступени электрохимической активности. Первая ступень характеризуется низкими токами обмена, на анодной поляризационной кривой ей соответствует предельный ток. Причина этого заключается в образовании на поверхности литиевого электрода плохо растворимых в электролите окисных, гидро-окисных или солевых пленок в результате взаимодействия его со следами воды, примесей, а иногда и компонентами электролита. Часто пленки имеют полупроводниковый и полимерный характер. Образующиеся пленки служат защитой литиевого электрода от коррозии. Анодное растворение при высоких плотностях тока (вторая ступень) является результатом частичного или полного разрушения пленки, которым объясняется увеличение стандартной плотности тока обмена. Так, обычной запассивированной поверхности лития соответствуют токи обмена 0,80 и 1,47 мА/см2, на свежем срезе лития — 10,2 и 3,28 мА/см2 для ПК и этиленкарбоната соответственно. На жидких литиево-амальгамных электродах значения токов обмена обычно выше, чем на твердых литиевых.
Однако литиевые электроды, как правило, показывают две ступени электрохимической активности. Первая ступень характеризуется низкими токами обмена, на анодной поляризационной кривой ей соответствует предельный ток. Причина этого заключается в образовании на поверхности литиевого электрода плохо растворимых в электролите окисных, гидро-окисных или солевых пленок в результате взаимодействия его со следами воды, примесей, а иногда и компонентами электролита. Часто пленки имеют полупроводниковый и полимерный характер. Образующиеся пленки служат защитой литиевого электрода от коррозии. Анодное растворение при высоких плотностях тока (вторая ступень) является результатом частичного или полного разрушения пленки, которым объясняется увеличение стандартной плотности тока обмена. Так, обычной запассивированной поверхности лития соответствуют токи обмена 0,80 и 1,47 мА/см2, на свежем срезе лития — 10,2 и 3,28 мА/см2 для ПК и этиленкарбоната соответственно. На жидких литиево-амальгамных электродах значения токов обмена обычно выше, чем на твердых литиевых.
 . Изучена также кинетика электроосаждения и растворения на инертных электродах. По электрохимическим характеристикам в апротонных растворителях натрий аналогичен литию.
. Изучена также кинетика электроосаждения и растворения на инертных электродах. По электрохимическим характеристикам в апротонных растворителях натрий аналогичен литию.

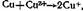 в результате чего медь будет растворяться до тех пор, пока в объеме раствора не установится равновесная концентрация ионов Си (I). В больших объемах электролитов вследствие этой реакции наблюдаются большие коррозионные потери, которые могут быть снижены введением в раствор специальных ингибиторов.
в результате чего медь будет растворяться до тех пор, пока в объеме раствора не установится равновесная концентрация ионов Си (I). В больших объемах электролитов вследствие этой реакции наблюдаются большие коррозионные потери, которые могут быть снижены введением в раствор специальных ингибиторов.
Вторая группа работ проведена непосредственно с целью установления коррозионной устойчивости меди как конструкционного материала для органических сред, в основном это растворы электролитов в органических кислотах и спиртах. Во многих из этих работ наряду с медью исследованы различные марки сталей и сплавов с целью замены корродирующей меди. Активное растворение меди в ряде кислот, в частности монокарбоновых, приводит к лимитирующей роли ступеней катодной реакции в процессе растворения. Анодное поведение меди изучено в безводных и водных спиртовых растворах. При этом наблюдается интересная закономерность в некоторых спиртах (этанол, этиленгли-коль): вода по отношению к меди выступает в роли активного агента, увеличивающего коррозию. Очевидно, процессы коррозии меди и ее пассивации в водно-спиртовых растворах очень сложны, и в них участвуют молекулы обоих компонентов раствора. В одних случаях вода выступает в роли пассиватора, а спирт — активатора, в других — наоборот, в зависимости от соотношения их концентраций. Двойственная роль молекул воды отмечалась и в других случаях. Наряду с электрохимической для меди характерна и химическая коррозия благодаря присутствию растворенного кислорода.
Наряду с анодным растворением установлена возможность анодного окисления ионов серебра в неводных растворах. В жидком аммиаке получены соединения Ag (I) и Ag(II); последние быстро разлагаются, окисляя растворитель. В безводной уксусной кислоте в присутствии ацетата натрия на платиновом аноде с очень низким выходом по току получен диацетат серебра.
 .
.



