Электровыделение металлов |
Неметаллы
Исследования по электровосстановлению неметаллов можно разделить в основном на две группы: восстановление анионов и восстановление элементов в нейтральном состоянии. К электровосстановлению анионов относится также электровосстановление оксидов.
В случае восстановления анионов первостепенное значение приобретает природа органического растворителя. Большинство анионов в протолитических растворителях стабилизируется водородными связями. Ввиду отсутствия доноров протонов в апротонных растворителях активность анионов повышается, и стабилизация их часто происходит путем взаимодействия с катионами. Прочность комплексов катионов с анионами в апротонных растворителях значительно выше, чем в протолитических, например в воде. Это различие в молекулярном состоянии анионов в зависимости от природы органической среды сказывается на протекании электродного процесса.
При восстановлении элементарных неметаллов основную роль играет растворимость неметалла в органическом растворителе, величина которой изменяется в широких пределах. Наибольшее количество исследований приходится в обоих случаях на кислород, серу и фосфор. Наименее изучены углерод (естественно, исключая область органических соединений), кремний и азот. В табл. 8 приложения приведены электрохимические параметры, характеризующие процесс восстановления некоторых элементов из молекулярного состояния.
 . В растворителях (АН, ПК, ДМФ, ДМА,
. В растворителях (АН, ПК, ДМФ, ДМА,
 и донорным числом растворителя, с ростом которого потенциалы полуволн сдвигаются в положительную сторону.
и донорным числом растворителя, с ростом которого потенциалы полуволн сдвигаются в положительную сторону.
 .
.
В нескольких работах наряду с другими элементами полярогра-фически изучено электровосстановление кремния из его тетрага-логенидов. Электровосстановление осуществляется в две ступени, возможно, до элементарного состояния. Определен потенциал полуволны первой ступени в ДМСО.
 в зависимости от материала катода,
в зависимости от материала катода,
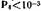 моль/л
моль/л
 На свинцовых катодах возможно получение высших гидридов фосфора.
На свинцовых катодах возможно получение высших гидридов фосфора.
 . Суспендированный в сульфолане пентаоксид фосфора также восстанавливается до фосфористой кислоты.
. Суспендированный в сульфолане пентаоксид фосфора также восстанавливается до фосфористой кислоты.
Восстановление как элементарного фосфора, так и его производных широко используется для электрохимического синтеза соединений фосфора.
Мышьяк. Показана возможность электровосстановления мышьяка до элементарного аморфного состояния из растворов его трихлорида в некоторых органических растворителях (ледяная уксусная кислота, АЦ, МЭК).
Кислород. Электровосстановление кислорода в органических растворителях изучено подробно методами полярографии, циклической вольтамперомстрии, электролиза при контролируемом потенциале, хронопотенциометрии, нередко с привлечением неэлектрохимических измерений на различных катодах в присутствии разнообразных фонов в многочисленных средах.
 см/с.
см/с.


 очень нестабилен в присутствии доноров протонов и диспропорционирует по кислорода и пероксида водорода
очень нестабилен в присутствии доноров протонов и диспропорционирует по кислорода и пероксида водорода
 При этом донором протонов может служить фоновый электролит.
При этом донором протонов может служить фоновый электролит.
Как в случае протолитических, так и апротонных растворителей исследования первой стадии восстановления кислорода более многочисленны, чем второй.
 на катодной поверхности при отрицательных зарядах исключает специфическую адсорбцию как реагирующей частицы, так и продукта реакции). Соответственно этим направлениям ведутся исследования электровосстановления элементарной серы, диоксида серы и ее анионов в основном в апротонных растворителях.
на катодной поверхности при отрицательных зарядах исключает специфическую адсорбцию как реагирующей частицы, так и продукта реакции). Соответственно этим направлениям ведутся исследования электровосстановления элементарной серы, диоксида серы и ее анионов в основном в апротонных растворителях.

 наблюдалось на платиновом, графитовом
наблюдалось на платиновом, графитовом
 . Обе стадии процесса
. Обе стадии процесса
необратимы, первая носит диффузионный характер, скорость второй определяется кинетикой или адсорбцией.

 подвергается
подвергается
 (п=1, 2). Дитионат способен к необратимой адсорбции на электроде, образуя слаборастворимую пленку, пассивирующую электродную поверхность.
(п=1, 2). Дитионат способен к необратимой адсорбции на электроде, образуя слаборастворимую пленку, пассивирующую электродную поверхность.
 претерпевает в апротонных растворителях
претерпевает в апротонных растворителях


![]() . Все стадии протекают с образованием сольватов. До элементарной серы восстанавливается в апротонных растворителях хлористая сера. Процесс двухэлектронный.,
. Все стадии протекают с образованием сольватов. До элементарной серы восстанавливается в апротонных растворителях хлористая сера. Процесс двухэлектронный.,

 см/с.
см/с.
 в значительной мере определяется природой катиона фонового электролита. Изучен механизм катодного восстановления полисульфидных растворов в апротонных растворителях.
в значительной мере определяется природой катиона фонового электролита. Изучен механизм катодного восстановления полисульфидных растворов в апротонных растворителях.
Галогены. В органических средах исследовалось электровосстановление как элементарных галогенов, так и их анионов. Наибольшее количество работ посвящено йоду и его производным.
 как правило, происходит ступенчато. Первые необратимые ступени протекают с участием нескольких электронов и образованием свободных галогенов. Вторая ступень одноэлектронна, продуктом ее является галогенид-ион. На скорость протекающих электродных процессов большое влияние оказывает природа фонового электролита. В замедленной стадии переноса электрона принимают участие нейтральные молекулы растворителя.
как правило, происходит ступенчато. Первые необратимые ступени протекают с участием нескольких электронов и образованием свободных галогенов. Вторая ступень одноэлектронна, продуктом ее является галогенид-ион. На скорость протекающих электродных процессов большое влияние оказывает природа фонового электролита. В замедленной стадии переноса электрона принимают участие нейтральные молекулы растворителя.
 Обе ступени восстановления необратимы как в случае йода, так и в случае брома в изученных растворителях (АН, ДМФ, ДМСО).
Обе ступени восстановления необратимы как в случае йода, так и в случае брома в изученных растворителях (АН, ДМФ, ДМСО).
 Для отдельных растворителей найдены кинетические параметры электродной реакции, энергии активации ступеней восстановления.
Для отдельных растворителей найдены кинетические параметры электродной реакции, энергии активации ступеней восстановления.
В заключение следует отметить, что в работе сделана попытка на основании обобщения кинетических закономерностей процесса электровосстановления анионов, в том числе и анионов металлов, создать теорию их разряда. Показано, что зависимость скорости катодной реакции от потенциала электрода, концентрации и заряда катионов фона, природы электрода и природы растворителя может быть описана на основе феноменологической теории замедленного разряда.



