Электровыделение металлов |
Металлы восьмой группы
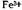 часто наступает при потенциале, более положительном, чем анодное растворение ртути.
часто наступает при потенциале, более положительном, чем анодное растворение ртути.
Комплексные ионы двухвалентного и трехвалентного железа в основном восстанавливаются многоступенчато, каждой ступени соответствует одноэлектронное восстановление.
О кинетических параметрах процесса электровосстановления ионов железа имеется лишь незначительная качественная информация, количественные данные получены только для комплексообразующих электролитов.
![]() имеет высокая комплексообразующая способность этих металлов. При этом следует учитывать образование комплексов с растворителем, фоном и комплексообразующими добавками в случае присутствия последних. В перхлоратных растворах, за редким исключением, восстановление происходит в одну ступень до металла. В комплексообразующих электролитах наблюдается ступенчатое восстановление, относящееся к комплексам различного состава. Количество ступеней достигает трех. Конечным продуктом восстановления может быть не только металл, но и комплексы нулевой валентности.
имеет высокая комплексообразующая способность этих металлов. При этом следует учитывать образование комплексов с растворителем, фоном и комплексообразующими добавками в случае присутствия последних. В перхлоратных растворах, за редким исключением, восстановление происходит в одну ступень до металла. В комплексообразующих электролитах наблюдается ступенчатое восстановление, относящееся к комплексам различного состава. Количество ступеней достигает трех. Конечным продуктом восстановления может быть не только металл, но и комплексы нулевой валентности.

 — на один.
— на один.
 , а также адсорбционные процессы на поверхности катодов с участием молекул растворителя, фонового электролита и образующихся комплексов исследуемых металлов.
, а также адсорбционные процессы на поверхности катодов с участием молекул растворителя, фонового электролита и образующихся комплексов исследуемых металлов.

 и т. д.) ведут себя иначе. Для комплексов данных металлов на полярограммах наблюдается одна волна, соответствующая восстановлению центрального иона до металла, разряд в большинстве случаев близок к обратимому. Работы по изучению электрохимического поведения хелатов переходных металлов имеют практическое значение. Они позволяют решать вопросы электрокатализа, гальваностегии, электросинтеза и электроаналитического определения металлов.
и т. д.) ведут себя иначе. Для комплексов данных металлов на полярограммах наблюдается одна волна, соответствующая восстановлению центрального иона до металла, разряд в большинстве случаев близок к обратимому. Работы по изучению электрохимического поведения хелатов переходных металлов имеют практическое значение. Они позволяют решать вопросы электрокатализа, гальваностегии, электросинтеза и электроаналитического определения металлов.
Электровосстановление платиновых металлов изучено лишь в комплексообразующих неводных растворителях. Основными объектами исследования служили комплексы осмия, родия, иридия с органическими лигандами. Изучение их представляет как теоретический интерес в плане выяснения основных закономерностей процессов комплек-сообразования в неводных средах и стабилизации низших степеней окисления элементов в апротонных растворителях, так и практический, поскольку некоторые из них люминесцентны и могут служить объектами превращения световой энергии, в том числе и солнечной, в химическую.
Как правило, комплексы платиновых металлов восстанавливаются многоступенчато (3—4 ступени). Обратимость процесса электровосстановления определяется природой лигандов и строением комплекса, иногда температурой. Первые одна-две ступени одноэлектронны и обратимы, последующие— необратимы, в процессах, соответствующих им, может принимать участие несколько электронов. Аналогично при электровосстановлении ведут себя комплексы рения.



