Электровыделение металлов |
Методы и приемы исследований
Исследования в основном проводятся в герметизированных ячейках, заполненных сухим инертным газом, чаще всего азотом или аргоном. В качестве вспомогательных электродов в классической полярографии используют ртутное дно, при других вольт-амперных измерениях — инертный или исследуемый металл.
В качестве фоновых электролитов при электрохимических исследованиях в неводных растворах наиболее часто применяют перхлораты лития, натрия и тетраалкиламмония, йодиды и хлориды лития и тетраалкиламмония. Однако и в присутствии фоновых электролитов сопротивление неводных растворов часто остается достаточно высоким, что вызывает искажение результатов электрохимических измерений.
Для минимизации омического сопротивления ячейки, его расчета либо исключения предложен ряд специальных методик исследования и приборов.
 . Особого внимания заслуживает применение вращающегося платинового электрода, который обладает высокой чувствительностью, сочетающейся с иными преимуществами твердых электродов (отсутствие колебаний силы тока, обусловленных капанием на ртутном капельном электроде, емкостного тока). На вращающихся платиновых электродах целесообразно исследовать растворы деполяризаторов, в которых вследствие низких коэффициентов диффузии весьма малы диффузионные токи, так как здесь предельный ток во много раз больше, чем на ртутном электроде. На таком электроде редко появляются максимумы. Оптимальными условиями работы вращающегося платинового электрода являются строго постоянные температура и скорость вращения электрода, обеспечивающие постоянство диффузионного тока и низкие концентрации деполяризатора, позволяющие избежать изменения электродной поверхности из-за осаждения металлов. Большое значение имеет форма электрода. При вольт-амперных измерениях на твердых электродах довольно часто используют скорости изменения потенциала — гораздо большие, чем в классической полярографии на ртутном капельном электроде. Широкое распространение в последнее время при исследовании неводных растворов получили циклическая вольтамперометрия (осциллополярография) и метод хропопотенциометрии, при этом применяются как твердые, так и ртутный рабочие электроды.
. Особого внимания заслуживает применение вращающегося платинового электрода, который обладает высокой чувствительностью, сочетающейся с иными преимуществами твердых электродов (отсутствие колебаний силы тока, обусловленных капанием на ртутном капельном электроде, емкостного тока). На вращающихся платиновых электродах целесообразно исследовать растворы деполяризаторов, в которых вследствие низких коэффициентов диффузии весьма малы диффузионные токи, так как здесь предельный ток во много раз больше, чем на ртутном электроде. На таком электроде редко появляются максимумы. Оптимальными условиями работы вращающегося платинового электрода являются строго постоянные температура и скорость вращения электрода, обеспечивающие постоянство диффузионного тока и низкие концентрации деполяризатора, позволяющие избежать изменения электродной поверхности из-за осаждения металлов. Большое значение имеет форма электрода. При вольт-амперных измерениях на твердых электродах довольно часто используют скорости изменения потенциала — гораздо большие, чем в классической полярографии на ртутном капельном электроде. Широкое распространение в последнее время при исследовании неводных растворов получили циклическая вольтамперометрия (осциллополярография) и метод хропопотенциометрии, при этом применяются как твердые, так и ртутный рабочие электроды.
В случае больших объемных сопротивлений, по существу, зависящих от поляризующего потенциала, эффективность методов их компенсации сильно снижается. Одним из перспективных методов изучения электрохимических систем, обладающих значительным сопротивлением, является импульсная поляризация. Метод в отличие от поляризации постоянным током дает возможность четко разграничить омическое сопротивление и поляризационное сопротивление электрохимической реакции. Принципиальная схема аппаратуры обычно представляет собой вариант импульсной цепи, модернизированной для измерений в неводных электролитах.
В методе разностной осциллополярографии не требуется высокой электропроводности раствора, что делает этот метод особенно выгодным для исследования неводных сред.
Гораздо реже для определения механизма и кинетики катодного выделения металлов из неводных растворов применяются другие методы: импедансометрия, позволяющая кроме кинетических параметров (тока обмена, константы скорости, числа переноса) определить также строение двойного электрического слоя; электролиз при контролируемом потенциале, когда необходимо изучить выделяющиеся на катоде продукты; хроновольтамперометрия; различные виды производной полярографии. Создана специальная аппаратура для полярографических исследований в неводных растворах при повышенных давлениях.
Метод вольтамперометрии с медленным наложением потенциалов на микроэлектрод, в частности классическая полярография, способен дать довольно полную характеристику электродного процесса и молекулярного состояния электролита. Из вольтамперо-грамм (полярограмм) можно сделать заключение об обратимости или необратимости электродных процессов, о наличии процессов комплсксообразования в электролитах, определить число электронов, принимающих участие в электродном процессе, рассчитать нормальные потенциалы, коэффициенты диффузии, кинетические константы, а также коэффициенты активности.
В большинстве работ по приложению полярографии к изучению катодного выделения металлов из неводных сред исследования ограничиваются определением значений потенциалов полуволн без учета величины контактного потенциала и коэффициента Ь в известном уравнении

 с некоторым приближением можно считать стандартным электродным потенциалом. Для обратимых процессов это приближение вполне достаточно, для необратимых— весьма грубо.
с некоторым приближением можно считать стандартным электродным потенциалом. Для обратимых процессов это приближение вполне достаточно, для необратимых— весьма грубо.

 .
.
В качестве примеров исследований такого рода можно привести работы.
Сопоставление потенциалов полуволн разных катионов в одном растворителе и одного катиона в разных растворителях затруднено применением разных электродов сравнения. В некоторых работах использовались двухэлектродные ячейки. Для количественных определений наиболее серьезного внимания заслуживают потенциалы полуволн, измеряемые по отношению к водному насыщенному каломельному электроду; они как уже отмечалось, наиболее многочисленны.
 и коэффициента Ь рассчитаны коэффициенты диффузии ионов восстанавливающегося на катоде металла, скорость протекающего электродного процесса, количественные параметры комплексообразования ионов металлов в электролите.
и коэффициента Ь рассчитаны коэффициенты диффузии ионов восстанавливающегося на катоде металла, скорость протекающего электродного процесса, количественные параметры комплексообразования ионов металлов в электролите.
Изучение поляризации выделения металлов на твердых и жидких катодах из неводных растворов даст ценную информацию для выяснения специфики электроосаждения данных металлов с целью получения их электролитическим путем. Поляризационные кривые, снятые при различных скоростях поляризации в большинстве случаев в потенциостатическом режиме, позволяют определить характер электродного процесса (обратимый — необратимый), его интенсивность (токи обмена, числа переноса катодного и анодного процессов, константы скорости, энергию активации), зависимость характера электродного процесса от концентрации отдельных компонентов электролита, силы тока, поверхности электрода. Метод поляризационных кривых позволяет также изучать кинетику отдельных стадий стадийных электродных процессов.
Методы осциллополярографии и хронопотенциометрии служат для количественных определений кинетических параметров катодного восстановления металлов из певодных сред.
 Пиковый ток осциллограммы соответствует высоте волны полярограммы и отличается от полярографического предельного тока тем, что является функцией скорости развертки потенциала. Величина потенциала пика разнится от потенциала значения полуволны на постоянную величину и подобно последнему может характеризовать потенциал выделения восстанавливающего иона металла:
Пиковый ток осциллограммы соответствует высоте волны полярограммы и отличается от полярографического предельного тока тем, что является функцией скорости развертки потенциала. Величина потенциала пика разнится от потенциала значения полуволны на постоянную величину и подобно последнему может характеризовать потенциал выделения восстанавливающего иона металла:

 соотносятся очень просто:
соотносятся очень просто:
 (2—20)
(2—20)
где а — коэффициент (число) переноса катодного процесса.
Пространственное расположение пиков катодного и анодного токов позволяет судить об обратимости электродного процесса.
 для электродных процессов, контролируемых диффузией, переносом заряда, а также одновременно обоими параметрами, позволяющие определить константы скорости катодного и анодного процессов, числа переноса, коэффициенты диффузии разряжающихся ионов. Так, в случае катодного процесса, контролируемого переносом заряда, зависимость величин потенциалов пика и полупика от скорости изменения потенциалов дается следующим выражением:
для электродных процессов, контролируемых диффузией, переносом заряда, а также одновременно обоими параметрами, позволяющие определить константы скорости катодного и анодного процессов, числа переноса, коэффициенты диффузии разряжающихся ионов. Так, в случае катодного процесса, контролируемого переносом заряда, зависимость величин потенциалов пика и полупика от скорости изменения потенциалов дается следующим выражением:

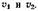 Выражение (2—21), как и (2—20), может быть использовано для определения коэффициента переноса а.
Выражение (2—21), как и (2—20), может быть использовано для определения коэффициента переноса а.
 :
:

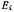 — потенциал в начале развертки.
— потенциал в начале развертки.
Хронопотенциометрия формально обратна вольтамперометрии при заданном напряжении. Она заключается в наложении на рабочий электрод контролирующего тока и измерении потенциала во времени.
 — время, необходимое для полного восстановления деполяризатора в приэлектродном слое (т. е. время, за которое поверхностная концентрация реагирующего вещества падает до нуля). В простейшем случае подачи peaтирующего вещества к электроду лишь через диффузию переходное время определяется зависимостью
— время, необходимое для полного восстановления деполяризатора в приэлектродном слое (т. е. время, за которое поверхностная концентрация реагирующего вещества падает до нуля). В простейшем случае подачи peaтирующего вещества к электроду лишь через диффузию переходное время определяется зависимостью

где С—концентрация деполяризатора в объеме раствора; D — коэффициент диффузии; i — плотность тока. Подобные зависимости получены и для более сложных случаев электродного процесса. По виду зависимости силы тока от переходного времени определяется характер диффузионного процесса. Эта зависимость позволяет также рассчитать коэффициенты диффузии разряжающихся частиц. Зависимости потенциала от времени дают возможность определить константы скорости электродных процессов и число переноса катодного процесса а, которое характеризует долю потенциала, благоприятствующего данному процессу.
Исследование катодных процессов электровыделения металлов водной группы из органических сред направлено на решение следующих задач: выяснение возможности электроосаждения металлов данной группы на активные поверхности, неустойчивые в водных растворах, и получение более качественных покрытий, чем в воде; изучение особенностей электрохимического поведения металлов, для чего неводные растворители, особенно апротонные, часто представляют более широкие возможности, чем водные растворы; определение возможностей аналитического определения металлов, особенно их малых количеств, электрохимическим путем; изучение молекулярного состояния электролита.
Количественно механизм электровыделения металлов можно охарактеризовать наиболее полно при помощи имеющихся в литературе полярографических данных. В табл. 11 приложения сведены данные по потенциалам полуволн и предлогарифмическим коэффициентам восстанавливающихся на ртутном капельном электроде ионов металлов (анион — перхлорат) по отношению к водному насыщенному каломельному электроду.
 при данных условиях представляется наиболее
при данных условиях представляется наиболее
подходящей для характеристики механизма электродного процесса как возможно полно исключающая влияние побочных процессов (в частности, комплексообразования) на электродный процесс. В целом сходимость данных, полученных различными авторами в неводных растворах, значительно хуже, чем в водных. Основные причины этого заключаются в неодинаковой степени обезвоживания и очистки растворителя, частичном разложении растворителя, использовании различных фоновых электролитов. Кинетику происходящих катодных процессов характеризуют данные табл. 7 приложения.
 . Эти величины взаимосвязаны со стандартной константой скорости следующими соотношениями:
. Эти величины взаимосвязаны со стандартной константой скорости следующими соотношениями:

 — концентрация металла на электроде.
— концентрация металла на электроде.
 приведены в табл. 8 приложения наряду с коэффициентами диффузии D, характеризующими скорость доставки восстанавливающихся частиц к электроду.
приведены в табл. 8 приложения наряду с коэффициентами диффузии D, характеризующими скорость доставки восстанавливающихся частиц к электроду.



