Электровыделение металлов |
Кислотно-основное взаимодействие и электропроводность неводных растворов
 и как следствие этого
и как следствие этого
уменьшением эффективного ионного радиуса. Отмеченную закономерность можно считать общей. Сводится она к следующему:
С увеличением кристаллографического радиуса либо уменьшением жесткости катионов степень их сольватации основными (в частности, протофильными) растворителями уменьшается. Очевидно, что изменение подвижности катионов будет антибатно степени сольватации.

 будет уменьшаться.
будет уменьшаться.
Закономерности изменения чисел сольватации ионов в зависимости от относительной кислотности (основности) иона и растворителя определяются высказанными положениями (табл. 3 приложения).
 число сольватации возрастает. Во многих случаях можно проследить конкуренцию основности растворителя и анионов.
число сольватации возрастает. Во многих случаях можно проследить конкуренцию основности растворителя и анионов.

Закономерности изменения подвижности ионов, определяемые их эффективным (стоксовым) радиусом, следовательно, числом сольватации, также согласуются с рассмотренными положениями о сольватации ионов.
 в ряде растворителей как функция кристаллографического радиуса ионов. Поскольку выбранные для иллюстрации данной зависимости ионы однотипны, очевидно, что относительная кислотность катионов и относительная основность анионов снижаются с увеличением кристаллографического радиуса. Как видно из рис. 18, подвижность катионов с повышением
в ряде растворителей как функция кристаллографического радиуса ионов. Поскольку выбранные для иллюстрации данной зависимости ионы однотипны, очевидно, что относительная кислотность катионов и относительная основность анионов снижаются с увеличением кристаллографического радиуса. Как видно из рис. 18, подвижность катионов с повышением
 — в соответствии с формальным использованием уравнения Стокса (1—35).
— в соответствии с формальным использованием уравнения Стокса (1—35).
![]() и подвижность ионов в двух растворителях, относящихся к различным классам.
и подвижность ионов в двух растворителях, относящихся к различным классам.

 В отличие от катионов анионы весьма слабо сольватированы в слабопротогенном растворителе — метаноле, и совершенно не сольватированы в сильноосновном — ДМФ.
В отличие от катионов анионы весьма слабо сольватированы в слабопротогенном растворителе — метаноле, и совершенно не сольватированы в сильноосновном — ДМФ.

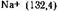 , что объясняется ослаблением (либо отсутствием) сольватации катионов-кислот кислотным растворителем.
, что объясняется ослаблением (либо отсутствием) сольватации катионов-кислот кислотным растворителем.
Аналогичный ряд подвижностей, полностью соответствующий кристаллографическим радиусам катионов, и обратный тому, какой имеет место в основных растворителях, наблюдается в абсолютной серной кислоте.
![]() т. е. чем выше степень сольватации.
т. е. чем выше степень сольватации.



