Электровыделение металлов |
Кислотность апротонных кислот
В большинстве случаев применяемые в электрохимической практике растворители относятся к электронно-донорным (основным), по отношению к которым соли металлов проявляют свойства апротонных кислот. Соли металлов III—V групп периодической системы элементов классифицируются как кислоты в рамках электронной теории кислот и оснований. Что же касается солей вообще, то каждая из них считается апротонной кислотой в основном растворителе, поскольку в таких системах преимущественно соль-ватируется катион. Отсюда видно, что объекты, являющиеся кислотами в рамках электронной теории (теории Льюиса), которые мы далее будем обозначать как L-кислоты, являются частным случаем апротонных кислот, которые мы далее будем обозначать как U-кислоты (т. е. кислоты по Усановичу).
 и т. д. Эти величины определяются по различным экспериментальным методикам, и, поскольку, сопоставляя силу различных Н-кислот в одном растворителе, приходится определять концентрацию одного и того же катиона лиония, задача решается сравнительно несложно с помощью экспериментальных либо расчетных методик.
и т. д. Эти величины определяются по различным экспериментальным методикам, и, поскольку, сопоставляя силу различных Н-кислот в одном растворителе, приходится определять концентрацию одного и того же катиона лиония, задача решается сравнительно несложно с помощью экспериментальных либо расчетных методик.
Заметим, что значения констант диссоциации, определенные разными методами, различны, что обусловлено не только погрешностями соответствующих методик, но и принципиальными их различиями. Так, кондуктометрия позволяет определять равновесную концентрацию свободных (разумеется, сольватированных) ионов; в то же время спектрофотометрия дает информацию о суммарной концентрации ионов, находящихся как в свободном состоянии, так и в виде ионных ассоциатов (см. схемы (1—14) и (1—16)).
 а кислотность раствора триброми-
а кислотность раствора триброми-
 (В этом примере растворитель S не вступает с галоге-нидами в реакцию сольволиза; в противном случае задача еще более осложнилась бы.)
(В этом примере растворитель S не вступает с галоге-нидами в реакцию сольволиза; в противном случае задача еще более осложнилась бы.)

 соединения выступают по отношению к растворителю в роли основания). Однако подобные случаи весьма редки.
соединения выступают по отношению к растворителю в роли основания). Однако подобные случаи весьма редки.



 предложили сопоставительные ряды для некоторых U-кислот:
предложили сопоставительные ряды для некоторых U-кислот:

В работе индикаторным методом установлена следующая последовательность силы кислот в эфирах карбоновых кислот:
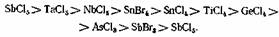

Не приходится говорить, что в рамках такого подхода нельзя сопоставлять ионофорные и ионогенные U-кислоты, во всяком случае без учета энергии кристаллической решетки первых.
В качестве меры относительной силы кислоты в работе была принята скорость ее каталитического действия на процесс деполимеризации паральдегида в эфирном растворе, в результате чего установлена последовательность:

Очевидные расхождения в приведенных рядах не следует рассматривать как противоречия. Причины этих расхождений могут заключаться в различии механизмов взаимодействия разных апротонных кислот с данным растворителем, в различии соотносительного влияния универсальной и специфической сольватации на каждую из кислот и т. д.

Решение аспекта кислотности неводных растворов апротонных кислот — сопоставление силы одной кислоты в разных растворителях— значительно труднее. В случае Н-кислот данная проблема решается разработкой единой шкалы кислотности, предложенной Н. А. Измайловым и далее развитой В. В. Александровым.Существуют иные методы сопоставления кислотности, обзор которых достаточно полно приведен в монографиях).
До сих пор отсутствует даже самый общий подход, пользуясь которым можно было бы сопоставить кислотность двух растворов, чьи кислые свойства определяются соответственно катионами
 Здесь можно назвать только оценочные методы определения относительной силы U(L)-кислот. В большинстве неводных растворителей U-кислоты, применяемые в композициях для электроосаждения металлов, являются слабыми электролитами. Поэтому в соответствии со схемой (1 —14) большая часть U(L)-кислоты, подвергшейся специфической сольватации, будет находиться в виде продукта присоединения либо в виде ионного ассоциата, — относительный выход, а в ряде случаев и константы образования которых определяются методами количественного физико-химического анализа. Сопоставление глубины взаимодействия в системе U(L)-кислота — растворитель может служить относительной мерой глубины взаимодействия, следовательно, силы данной кислоты по отношению к растворителю.
Здесь можно назвать только оценочные методы определения относительной силы U(L)-кислот. В большинстве неводных растворителей U-кислоты, применяемые в композициях для электроосаждения металлов, являются слабыми электролитами. Поэтому в соответствии со схемой (1 —14) большая часть U(L)-кислоты, подвергшейся специфической сольватации, будет находиться в виде продукта присоединения либо в виде ионного ассоциата, — относительный выход, а в ряде случаев и константы образования которых определяются методами количественного физико-химического анализа. Сопоставление глубины взаимодействия в системе U(L)-кислота — растворитель может служить относительной мерой глубины взаимодействия, следовательно, силы данной кислоты по отношению к растворителю.

![]() -алифатический спирт, закономерно уменьшаются с увеличением длины углеводородного радикала спирта.
-алифатический спирт, закономерно уменьшаются с увеличением длины углеводородного радикала спирта.



