Электровыделение металлов |
Кислотно-основные характеристики растворителя
Вопросы классификации растворителей, применяющихся в практике электроосаждения металлов, будут подробно рассмотрены в разделе 3.1.1. Здесь мы остановимся лишь на характеристиках растворителей, имеющих значение для обсуждения вопросов, которым посвящен раздел 1.4.
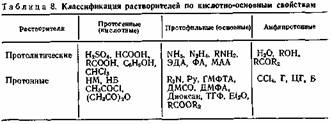
Прежде всего отметим широко распространенный принцип деления растворителей на протолитические и апротонные. В связи с тем что не выработан единый подход к трактовке и содержанию этих терминов, прокомментируем эту систему классификации. К протолнтическим относятся растворители, проявляющие по отношению к растворенному веществу протонно-донорную либо протонно-акцепторную функцию. К апротонным относят растворители, которые не могут принимать участие в процессах переноса протона. Если отнесение растворителя к классу протолитических в большинстве случаев может быть проведено априорно—на основании его химических свойств (так, к этому классу относятся спирты, карбоновые кислоты, фенолы и т. д.), то отнесение растворителя к классу апротонных может быть проведено лишь с учетом особенностей системы растворенное вещество — растворитель в целом. Так, бензол, который в системах с L-кислотами выступает как апротонный растворитель, будучи растворителем для очень сильных Н-кислот (например, жидкого фтористого водорода) либо для очень сильных оснований (например, жидкого аммиака), способен проявлять протонно-донорную либо протонно-акцептор-ную функцию:

В свою очередь, протолитические растворители в зависимости от отношения к растворенному соединению подразделяются на протогенные (кислые), протофильные и амфипротонные, т. е. растворители, которые в зависимости от химической природы растворенного вещества могут либо присоединять, либо отдавать протон (помимо только что приведенного, впрочем, достаточно экстравагантного примера с бензолом, к числу амфипротонных относятся кетоны. Кроме того, каждый из перечисленных классов органических соединений может в зависимости от природы партнера проявлять либо протонно-донорную, либо протонно-акцепторную функцию). К амфипротонным часто относят растворители, которые вступают с растворенным веществом лишь в универсальную сольватацию. В табл. 8 приведены в рамках данной классификации примеры отнесения растворителей к каждой из указанных групп.
Сложность проблемы количественного описания основности (кислотности) растворителей и неоднозначность ее решения обусловили появление большого числа работ в этом направлении, даже краткий обзор которых был бы вряд ли уместен в данной книге. Поэтому изложение этого вопроса ограничено здесь лишь прикладными аспектами и ни в коей мере не претендует на полноту. С современным состоянием вопроса читатель ознакомится в работах.
Наибольшее распространение получили спектральные и калориметрические шкалы основности, базирующиеся соответственно на сопоставлении спектральных характеристик какого-либо реперного соединения в данном растворителе с растворителем, выбранным в качестве стандарта (чаще всего н-гексаном), либо на тепловых эффектах растворения определенного химического соединения.
Одной из наиболее важных характеристик является величина основности В, введенная В. А. Пальмом и представляющая собой сдвиг полосы ОН фенола в ИК-спектрах этого реперного соединения в данном растворителе. Еще большее распространение получила калориметрическая шкала В. Гутмана донорных чисел (DN), представляющих собою энтальпию смешения пятихлори-стой сурьмы с данным растворителем. По-видимому, нет оснований предпочитать какую-либо разновидность этих параметров основности — спектральную либо калориметрическую. Установлено, что шкала донорных чисел DN при условии учета параметра поляризуемости растворителя, вводимого функцией Лоренца — Лорентца, хорошо коррелирует со спектральной шкалой основности В:

 а именно энергия переноса заряда 1-
а именно энергия переноса заряда 1-
этил-4-метоксикарбонилпиридиниййодида в соответствующем растворителе.
В литературе предложены корреляционные уравнения, с помощью которых учитываются неуклеофильность либо электрофиль-ность растворителей. Так, в работе выведено двухпараметровое уравнение, согласно которому растворитель характеризуется величиной

В. А. Пальм предложил четырехпараметровое уравнение, учитывающее полярные свойства растворителей (показатель преломления п и диэлектрическую проницаемость в):

 — отношение мольной теплоты растворения к мольному объему растворителя:
— отношение мольной теплоты растворения к мольному объему растворителя:

Параметры основности и кислотности наиболее употребимых в электрохимической практике растворителей приведены в табл. 2. приложения.



