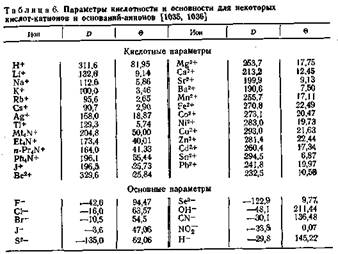
Электровыделение металлов |
Зависимость электропроводности от температуры
Температурные коэффициенты электропроводности.
Термодинамика активации процесса электропроводности
В большинстве случаев электропроводность электролитных растворов — удельная и эквивалентная — экспоненциально зависит от обратной температуры:

 — свободные (гиббсовы) энергии активации удельной
— свободные (гиббсовы) энергии активации удельной
![]() можно прогнозировать изменение удельной электропроводности от температуры.
можно прогнозировать изменение удельной электропроводности от температуры.

 определяется абсолютными величинами первого и второго слагаемых правой части уравнения (1—45).
определяется абсолютными величинами первого и второго слагаемых правой части уравнения (1—45).
Относительный температурный коэффициент удельной электропроводности находит Широкое применение в физико-химическом анализе жидких систем, поскольку диаграммы этого свойства позволяют с достаточной точностью определять стехиометрию продуктов присоединения.
 Среди них наибольшее распространение получила теория переходного состояния (ТПС), основы которой были сформулированы Эйрингом. За последние годы эта концепция была распространена на транспортные процессы в растворах — вязкое течение, электропроводность, ионная миграция, диффузия. Однако при этом часто не учитывали условный характер представлений ТПС, вследствие чего полученные выводы не всегда оказываются физически обоснованными.
Среди них наибольшее распространение получила теория переходного состояния (ТПС), основы которой были сформулированы Эйрингом. За последние годы эта концепция была распространена на транспортные процессы в растворах — вязкое течение, электропроводность, ионная миграция, диффузия. Однако при этом часто не учитывали условный характер представлений ТПС, вследствие чего полученные выводы не всегда оказываются физически обоснованными.
 константы скорости процесса в ТПС
константы скорости процесса в ТПС
в принципе применимо для идеального газа. Переход к жидкой фазе требует учета коэффициентов активности в растворе, что в общем случае затруднительно, а при рассмотрении скорости транспортных процессов, особенно электропроводности в рамках данной теории, практически невыполнимо.
В рамках ТПС можно вывести уравнения для различных транспортных свойств, в частности для подвижности отдельного иона:


![]() — весьма малая величина, и лишь предположительно считали ее равной единице. В последнее время М. И. Шахпаронов показал, что к не может быть больше 0,5.
— весьма малая величина, и лишь предположительно считали ее равной единице. В последнее время М. И. Шахпаронов показал, что к не может быть больше 0,5.
![]() .
.
С учетом этого обстоятельства в работе предложено следующее уравнение для предельной эквивалентной электропроводности:

В этих уравнениях величина предэкспоненциального множителя может быть рассчитана (для чего, очевидно, требуется знать легко находимую величину мольного объема индивидуального либо смешанного растворителя). С учетом числовых значений постоянных величин уравнение (1—48) преобразуется в выражение, позволяющее на основе экспериментальных данных рассчитывать свободную энергию активации ионной миграции при любой температуре, следовательно, энтальпию и энтропию этого транспортного процесса:


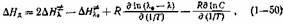
связывающее энтальпии равновесного и активационного процессов.
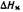 раствора совпадает с таковой растворителя.
раствора совпадает с таковой растворителя.
 где
где
l— среднее расстояние перескока иона.
 растворителя.
растворителя.
 определяются выражениями
определяются выражениями

 =—0,8733. Из уравнений (1—51) и (1—52) следует, что
=—0,8733. Из уравнений (1—51) и (1—52) следует, что



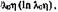 поэтому представим выражение (1—54) в виде
поэтому представим выражение (1—54) в виде
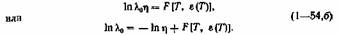
Продифференцировав (1— 54,а) по ЦТ, получим

 — интегральные величины энтальпии активации ионной миграции и вязкого течения, находимые из уравнений
— интегральные величины энтальпии активации ионной миграции и вязкого течения, находимые из уравнений
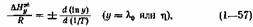

 т. е. при постоянной е (рис. 15).
т. е. при постоянной е (рис. 15).

 по выражению (1—44)
по выражению (1—44)
и по аналогичному экспоненциальному уравнению для вязкости, с одной стороны, и расчет этих величин на основе уравнений (1—51) и (1—52) —с другой, дают практически совпадающие результаты, так как величина

 весьма мало изменяется с составом растворителя, и этим изменением можно пренебречь.
весьма мало изменяется с составом растворителя, и этим изменением можно пренебречь.
Универсальные растворители. В данном случае под универсальными растворителями будем понимать среды, для которых выполняется соотношение (1—38). В этом случае из выражений (1—55) и (1—38) следует


Выражение (1—53,а) с учетом уравнений (1—58) и (1—59) может быть представлено в виде

 нелинейны и описываются по-
нелинейны и описываются по-

В этом случае уравнение (1—60) преобразуется к виду

 как функции состава симбатны.
как функции состава симбатны.
 в я -алифатических спиртах (кДж/моль, 298 К)
в я -алифатических спиртах (кДж/моль, 298 К)

 а в
а в
общем случае миграция ионов полностью описывается и определяется скоростью перескоков молекул растворителя в соседние положения равновесия и температурно-диэлектрическим влиянием среды.
 , более информативны по сравнению с интегральной характеристикой, включающей по крайней мере три эффекта: температурные изменения подвижности ионов, вязкости и диэлектрической проницаемости.
, более информативны по сравнению с интегральной характеристикой, включающей по крайней мере три эффекта: температурные изменения подвижности ионов, вязкости и диэлектрической проницаемости.

 неоправданно велики и по абсолютной величине, так как значительно превышают энергию теплового движения молекул растворителя.
неоправданно велики и по абсолютной величине, так как значительно превышают энергию теплового движения молекул растворителя.